- پیری چیست؟
- چرا ما پیر می شویم ؟
- چه تفاوتی بین سلولهای پیر و جوان موجودات وجود دارد ؟
- آیا می شود روند پیری را کند کرد و بر طول عمر افزود ؟
- و…
به گزارش بیوکمپ کانون تخصصی طراحی دارو و ژنتیک در کشور؛ به طورکلی پیری پدیده ای طبیعی است که بوسیله ی تغییرات بیولوژی ،فیزیولوژی ،بیوشیمی و اناتومی در سلولهای بدن ایجاد می شود. از لحاظ تئوری، پیری از زمان تولد شروع شده و در سراسر طول زندگی ادامه دارد. این تغییرات به مرور زمان بر عملکرد سلولها اثر می گذارند. تحولات پیری اغلب با افزایش احتمال مرگ و میر همراه است اما لزوما علت مرگ نیست.
بین جنسیت و طول عمر رابطه مستقیمی وجود دارد:
در سراسر جهان و در تمام جوامع زنان طول عمر بیشتری نسبت به مردان دارند.
امروزه زنان ۵ الی ۱۰سال بیشتر از مردان عمر می کنند.
در میان افرادی که بیش از ۱۰۰سال عمر کرده اند، ۸۵ درصد آنها زن هستند.
متوسط عمر زنان انگلیسی ۸۲/۱ در حالی که در مردان ۷۸/۱ است. از جمله دلایلی که زنان از مردان بیشتر عمر می کند می توان به این موارد اشاره کرد:
۱-طول تلومر (در زنان بیشتر از مردان)
۲-وجود دوکروموزوم x در زنان
۳- ابتلا دیرتر زنان (۱۰سال دیرتر از مردان) به بیماریهای قلبی –عروقی ، سکته و حملات قلبی
۴- امید به زندگی بالا در زنان
۵- طوفان تستسترون در انتهای دوران نوجوانی و اوایل ۲۰ سالگی در مردان
۶- مردان بیشتر سیگار میکشند، غذای بیشتری می خورند که باعث بالا رفتن کلسترول شان می شود.
۷- مردها درونگرا هستند و استرس را در خودشان نگه می دارند.
از جمله تئوری هایی که در زمینه علت پیر شدن ارائه شده است تئوری ژنتیکی می باشد:
بر اساس این تئوری پدیده پیری تحت کنترل عوامل ژنتیکی است. یکی از مشهورترین تئوریهای ژنتیک مربوط به پروفسورهایفلیک (Hayfilck) است که مشاهده کرد سلولهای حیوانات پیر کمتر از سلولهای حیوانات جوان تقسیم میشوند و نتیجه گرفته بود که دوران زندگی هر گونه تغییری در ارتباط با کدهای ژنتیکی در DNA است.
وی عنوان میکند که تعداد دفعاتی که سلول تقسیم میشود تحت کنترل ژنتیک است. زمانی که یک سلول به حد تعیین شدهاش رسید تقسیم متوقف میشود و پس از مرگ این سلول، سلول دیگری جایگزین نخواهد شد. در سال ۱۹۶۱ دکتر هایفیلک نشان داد هر سلول بدن انسان حداکثر ۵۰ بار میتواند تقسیم شود و بعد از آن دچار مرگ میشود. بنابراین پیری حاصل کاهش تدریجی در تعداد کل سلولها در بدن همراه با از دست دادن پیشرونده عملکرد آنهاست.
ژن PGC_1
دانشمندان زیستشناس دانشگاه UCLA موفق به کشف ژنی شدهاند که روند پیری را کند میکند. این محققان با فعال کردن ژنی به نام PGC-1 در مگس میوه فعالیت میتوکندری را افزایش دادهاند. میتوکندری، مولد انرژی در سلولهاست که علاوه بر کنترل رشد سلولها مدت زمان زندگی و مرگ آنها را اعلام میکند.
محققان دریافتند زمانی که ژن PGC-1 در دستگاه گوارش مگس افزایش مییابد، عمر این موجود به شکل قابل ملاحظهای بیشتر میشود. (طول عمر مگس میوه ۵۰ درصد افزایش می یابد).
پس از این تغییر، دانشمندان اثری از نابودی حیات سلولی در عصبها، عضلات و بافتها پیدا نکردند. طول عمر مگس میوه یا همان دروسفیلا ملانگستر حدود دو ماه است. علائم پیری پس از حدود یک ماه ظاهر شده و بتدریج فعالیت مگس کمتر و کمتر میشود تا بمیرد. ژن PGC-1 همچنین میتوکندری سلولهای پستانداران و حشرات را فعال و تنظیم میکند. حالا این سوال پیش میآید که افزایش فعالیت میتو کندری، استراتژی موثری در کاهش روند پیری هست یا خیر. اگر جواب مثبت است پس ژن PGC-1 یک فاکتور مهم محسوب میشود.
ژن Foxo3A
این ژن عضوی از خانوادهی ژنی FOXO ( شامل ۳ ژن FOXO1A ،FOXO3A و FOXO4 ) است که پروتئین حاصل از ترجمه آنها از دسته عوامل دخیل در رونویسی ژنها هستند و به دلیل وجود یک دُمین با سر چنگکی در همهی آنها، به این نام شناخته میشوند.پروتئینهای خانوادهی FOXO به دنبال اتصال هورمون انسولین به گیرندهاش در غشای سلول، که سبب به راه افتادن واکنشهای آبشاری فسفریلایون پروتئنهای مختلف میشود، فسفریله شده، اجازهی ورود به هسته را مییابند.
پروتئینهای FOXO در هستهی سلول سبب تنظیم رونویسی ژنهای موثر در متابولیسم میشوند. همچنین در عملکرد عامل رهاسازی فاکتورهای رشد دخالت میکنند. این پروتئین ظاهراً در تنظیم آپاپتوزیس از طریق دخالت در رونویسی ژنهای P53 و Bim نقش دارد. از این روخانواده پروتئینهای FOXOدر بسیاری از عملکردهای سلول از جمله تمایز، تکثیر سلولی، متابولیسم، کنترل حیات و مرگ سلولی نقش دارد.
FOXOx از ژنهای جذاب و مورد توجه در مطالعات ژنتیک پیری است. این ژن در انسان بر روی بازوی کوچک کرومزوم شمارهی ۱۳ واقع شده است. از سال ۱۹۹۰ که نقش FOXO3A در فرایند پیری کرمها و مگسها گزارش شد، بررسی نقش و تنوع آن در انسان مورد توجه ویژه قرار گرفت گروه تحقیقاتی «بررسی سلامت در دوران پیری» از مرکز تحقیقات زیستشناسی مولکولی بالینی دانشگاه کریستین-آلبرت آلمان با بررسی نمونهی DNA گرفته شده از ۳۸۸ مرد صد سالهی اروپایی و مقایسهی آن با نمونه DNA حاصل از ۷۳۱ مرد جوان، فرضیه وجود رابطه بین FOXO3A و طول عمر را تایید کردند.
ژن Mga2
انواع اکسیژن واکنشی (ROS)، یونهایی هستند که بعنوان یک محصول طبیعی از متابولیسم اکسیژن شکل میگیرند و نقش مهمی در سیگنال دهی سلولی ایفا میکنند. اما در اثر فشارهای محیطی مانند پرتوهای فرابنفش یا گرما و یا تماس با مواد شیمیایی مقدار این یونها تا حد زیادی افزایش مییابد و نتیجه آن تبدیل آسیبهای بیاهمیت و جزئی به آسیبهای سلولی در مولکولهای دی ان آ، آر ان آ و پروتئینها است که فشار اکسیداسیون را تشدید میکند. یک عامل دخیل در این انتشار پروکسید هیدروژن است. بدن تلاش میکند برای کاهش آسیب رسانی این ماده، آن را به آب و اکسیژن تبدیل کند. اما این فرایند ۱۰۰ درصد در بدن موفق نیست.
دراین تحقیق محققان ژنی را کشف کرده که در این فرایند نقش داشته و Mga2 نامیده میشود. این ژن در تغییر و تبدیل پیروکسید هیدروژن نقش دارند. محققان تلاش میکنند با بهره گیری از این ژن مکانیسم فشار اکسیداسیون را کنترل کرده و در نتیجه به طول عمر انسان بیافزایند.
ژنهای Age1 و Ras 1,2
جهش در ژنهای Age1 در c الگانس و۲و۱Rasدر مخمر باعث افزایش طول عمر می شود. بنابراین محققان نتیجه گرفتند که این ژنها در فرایند پیری نقش دارند.
ژن LAmin A
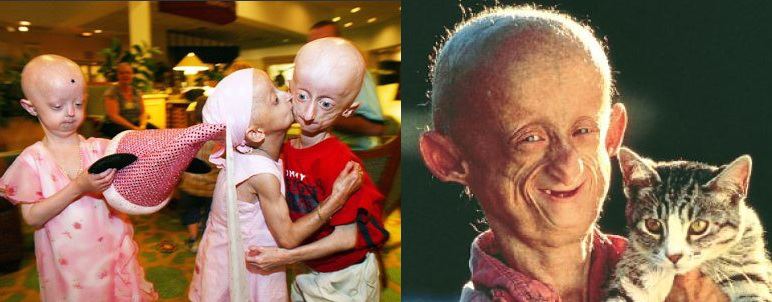
جهش در این ژن باعث بوجود آمدن سندرم هاچینسون-گلیفورد پروجریا (Hutchinson-Gilford progeria syndrome) می شود. این سندروم نوعی بیماری ژنتیکی نادر است که ظاهر کودک را پیر و فرتوت میکند.یکی از ناخوشایندترین بیماریهای شناخته شده برای اطفال است و درمانی ندارد؛ کودکانی که با این اختلال به دنیا میآیند اغلب در سن ۱۲سالگی میمیرند.
در این بیماری اندامهای کودک به سرعت پیر میشود و نشانههای پیری مانند ریزش مو، چروکهای پوستی و بیماریهای قلبی و پوکی استخوان در او بروز میدهد.
تمام اندامهای بدن کودک را تحت تأثیر قرار میدهد و علایمی که در بدن شخص مبتلا ظاهر میشود کاملاً متفاوت از پروسه طبیعی سالخوردگی است و به همین جهت قابل کنترل نیز نیست.یک بیماری اتوزومی غالب است .
علت آن نیز،اغلب بروز جهش های نقطه ای جدید در اگزون ۱۱ ژن LaminA برروی بازوی بلند کروموزوم یک است.کودکانی که با این اختلال به دنیا میآیند در ظاهر طبیعی هستند ولی به مرور به اختلال و تأخیر رشد مبتلا میشوند. در حدود سن یک سالگی نشانههای پیری مانند ریزش مو، چروکهای پوستی و از دست دادن چربی در این کودکان بروز میکند، بیشتر این کودکان در سن ۱۲سالگی میمیرند، علت مرگ این کودکان ابتلا به بیماریهای قلبی عروقی است.
علایم سندرم پیری زودرس
در ناحیه سر و صورت: طاسی، چروک شدن ناحیه پیشانی و اطراف چشمها، لرزه فک و دهان و افتادن دندانها،کوچکی جمجمه ،چشم های برآمده ، دماغ منقار مانند
در استخوانها: ماهیچههای ضعیف و استخوانهای نارس و شکننده و شکستگی لگن، همچنین، کوتاهی قد و بیماری قلبی و عروقی نیز، در تمام این کودکان دیده میشود.به علاوه علائمی از قبیل خاکستری شدن موی سر، آب مروارید، گونههای چروک افتاده، صدای سالخورده و خشن، پوکی استخوان، دیابت و انواع سرطانهای شایع نیز، ممکن است در فردی که دچار پروجریا شده دیده شود.
ژن عامل پیری زودرس ( سندرم پروگریا ) LMNA،نام دارد. جهش در این ژن باعث بوجود آمدن این سندرم میشود .این ژن حامل برنامه ساختاری دو پروتئین به نامهای لامین A و لامین C است .به کمک پروتئین لامین بی ( (LamineB این دو پروتئین نوعی بافت را تولید میکنند که درون غشاء هسته سلولی را میپوشاند. طی تقسیمهای سلولی غیرجنسی این بافت ناپدید میشود و به هسته این امکان را میدهد که به دو قسمت تقسیم میشود.وقتی غشایی جدید اطراف هر دو هسته ایجاد میشود، لامینها شروع به تولید بافت دیگری برای پوشاندن درون غشاء هستهای میکنند.
زمانی که لامینها دچار عیب میشوند، تقسیمات سلولی مختل میشود و سلولها به تدریج میمیرند و در نتیجه نمیتوانند تولیدمثل کنند و سلولهای جدید به وجود آورند. به نقص دراین لامینها اصطلاحا لامینوپاتی گفته میشود. در اوایل شروع تحقیق توسط دکتر لوی و همکاران، گروهی دیگر از محققان ارتباطی میان ژن LMNA و یک نوع لامینوپاتی به نام MAD کشف کردند.
در میان انواع لامینوپاتیها، MAD تنها نوع و اولین نوعی است که میتواند روی بافتهای گوناگون اثر گذارد که این ویژگی در بیماری پیری زودرس نیز وجود دارد. لوی و همکارانش پس از بررسیهای مختلف به این نتیجه رسیدند که نامنظمی در اگزون ۱۱ ,DNA سبب تولید لامینهای A غیرطبیعی میشود در حالی که روی لامینهای C تاثیر نمیگذارند.به دلایلی که هنوز نامعلوم است، جهش ژن LMNA سبب تولید پروتئین غیرطبیعی لامینها A تنها در برخی از سلولها میشود اما در کودکانی که پیری زودرس را به ارث میبرند جهش ژن مذکور سبب تولید لامین A غیرطبیعی در تمامی سلولها میشود.
ژن WRN
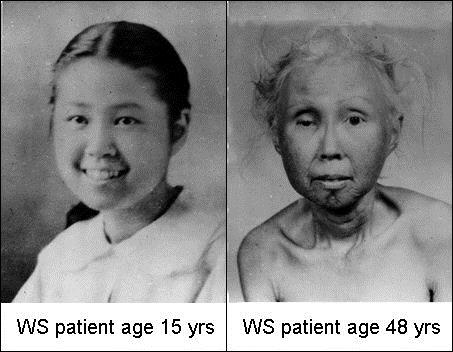
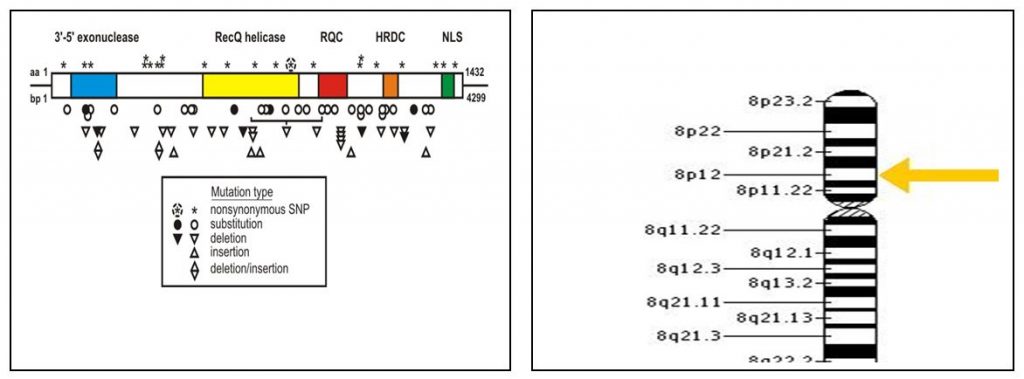
جهش در این ژن باعث سندرم ورنر می شود. سندرم ورنر یک بیماری ژنتیکی نادر است که بعلت موتاسیون ژن هلیکاز (WRN) که بر روی بازوی کوتاه کروموزوم شماره ۸ قرار دارد، ایجاد می شود.
این جهش منجر به عقب افتادن رشد فیبروبلاستها می شود و سلولها به سمت پیر شدن می روند و طول عمر آنها کم می شود. یک الگوی اتوزومال مغلوب دارد. شیوع آن ۱در هر یک میلیون نفر است.
این بیماری در اواخر دهه دوم عمر با خاکستری شدن رنگ موها بروز می کند. بدنبال آن تغییرات پوستی، خشونت صدا، کاتاراکت، زخم های پوستی و بالاخره دیابت تا سن ۲۴ سالگی رخ می دهد .
در سال ۱۹۸۵ معیارهای تشخیصی توسط Goto برای این سندرم پیشنهاد شد که عبارت بودند از:
الف) ویژگیهای خاص ظاهری شامل: کوتاهی قد، وزن کم، اندام نحیف و چهره شبیه پرندگان،
ب) تغییرات پوستی شبیه اسکلرودرمی شامل آتروفی پوست و عضلات، هیپرکراتوز، تلانژکتازی، سفتی و هیپرپیگمنتاسیون،
پ) علائم پیری زودرس شامل آلوپسی، موهای خاکستری ،کاتاراکت زودرس دوطرفه،
ج) اختلالات آندوکرین هیپوگنادیسم،
د) اختلالات ادراکی
ز) تومورهای بدخیمی
ر) ازدواج فامیلی